Journal club
USP4 regulates TUT1 ubiquitination status in concert with SART3 (BBRC, 2024)
USP4 regulates TUT1 ubiquitination status in concert with SART3
Jaehyun Kim, Takumi Taketomi, Atsuma Yamada, Yukino Uematsu, Kentaro Ueda, Tomoki Chiba, Fuminori Tsuruta.
Biochem Biophys Res Commun, 701:149557. 2024
DOI: 10.1016/j.bbrc.2024.149557
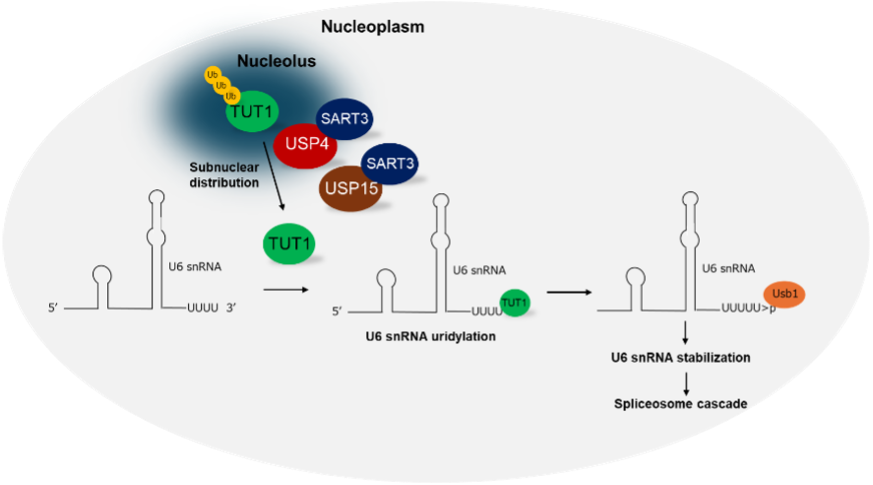
RNAスプライシングは、5種類のU snRNAと複数のタンパク質から構成されるスプライソソームによって触媒されている。スプライソソームの構成因子であるU6 snRNAの3’末端は、TUT1によってオリゴウリジンが付加された後、Usb1によって適切な長さに削られることで、細胞内での安定性が向上する。こうした3’末端の成熟化を経たU6 snRNAのオリゴウリジン配列にLsmタンパク質複合体が結合することで、U6 snRNAはスプライシングサイクルへと参加していく。
以前、著者らはユビキチン特異ペプチダーゼ(USP)の一員であるUSP15がTerminal uridylyl transferase 1(TUT1)を脱ユビキチン化し、これがU6 snRNAの3’部位をウリジル化することを発見した。さらに、脱ユビキチン化されたTUT1は核小体から核質へと移行し、RNAスプライシング全体を制御していた。USP15と相同性の高いタンパク質であるUSP4は、USP15といくつか基質を共有するため、USP4はTUT1を脱ユビキチン化することが推測されているが、その詳細は明らかになっていなかった。
本論文では、USP4とUSP15の構造的な類似性があることから、USP4は細胞内でUSP15と同様の機能を担うと推測し、USP4の機能解析を行っている。まず、USP4が相互作用するタンパク質をSTRINGによって探索し、USP4はU6 snRNAのリサイクリング因子であるsquamous cell carcinoma antigen recognized by T cells 3(SART3)を介してUSP15と相互作用を示す可能性を予測し、免疫沈降でUSP4-SART3, USP4-TUT1の相互作用を検証している。さらにUSP15とTUT1との相互作用がSART3によって増強される以前の報告と同様に、USP4とTUT1の相互作用についてもSART3により増強されることを示している。
また、USP4がTUT1を脱ユビキチン化すること、そしてSART3がUSP4によるTUT1の脱ユビキチン化を促進することを示している。最後に著者らは、USP15と同様、USP4によって脱ユビキチン化されたTUT1は核小体から核質へと移行し、さらにU6 snRNAのリサイクル因子であるSART3の発現によってこの局在移行は促進されることを示している。また、TUT1の局在移行にはUSP15よりもUSP4のほうが影響を与えていた。さらには、TUT1及びUSP4の発現によってU6 snRNAの発現量は増加傾向を示すことも示している。
以上、本論文ではUSP4がTUT1を脱ユビキチン化すること、それに伴いTUT1は核小体から核質に移行し、U6 snRNAの安定化を促すことでpre-mRNAのスプライシングが制御されている可能性を示唆している。